發布時間:2019-04-15 瀏覽次數:1654
2019年3月28日,為規范仿制藥審評和一致性評價工作,優化工作程序,強化服務指導,保證公平、公正、公開,國家藥品監督管理局組織制定并發布了《化學仿制藥參比制劑遴選與確定程序》。同時,原國家食品藥品監督管理總局于2016年5月發布的《關于發布仿制藥質量和療效一致性評價參比制劑備案與推薦程序的公告》(2016年第99號)被廢止,原發布的參比制劑相關文件與“2019年第25號公告”不一致的,以“2019年第25號公告”為準。
“2019年第25號”與“2016年第61號、99號”公告內容對比見表1:
表1 參比制劑公告文件對比
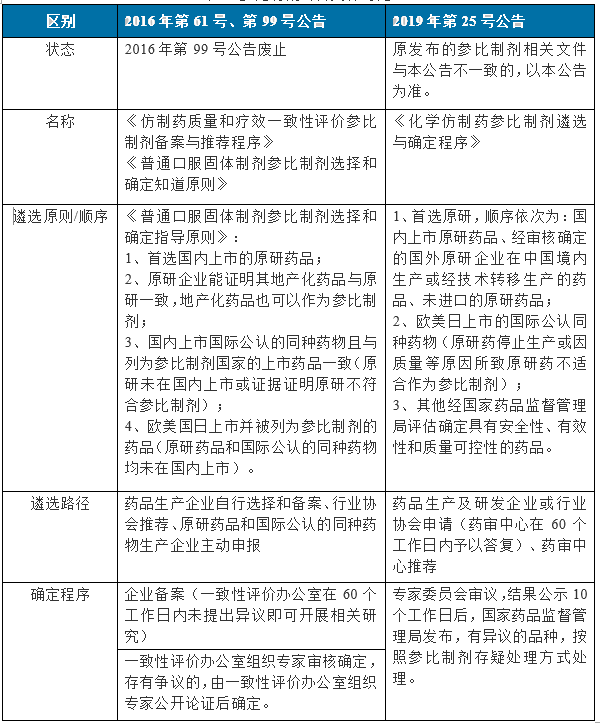
“2019年第25號”與“2016年61號”公告差異:
1、參比制劑選擇順序
“2019年第25號” 公告中參比制劑首選原研,其順序為:國內上市原研>國外原研地產化或技術轉移生產藥品>未進口的原研藥品>歐美日上市國際公認藥品>國內上市國際公認藥品>其它國家評估確定的藥品。
最新公告明確了國外原研企業在國內技術轉移生產的藥品經審核確定的也可作為參比制劑。另外,在原研停止生產或因質量原因不符合的前提下優先選擇國際公認同種藥品,且國外上市的優先于國內上市的國際公認藥品,最新公告明確了原研藥品和國際公認的同種藥物概念。
2、遴選路徑和確定流程
“2019年25號” 公告中新增藥審中心推薦,申請后60個工作日內即有答復,并在專家審議公示10個工作日后發布,較“2016年61號”中“企業備案后一致性評價辦公室60個工作日內未提出異議的即可開展研究”的流程更嚴謹、更合理。
3、參比制劑申請表
“2016年61號”公告中分別針對生產企業、行業協會和原研/國際公認藥品企業的參比制劑備案表、推薦表和申報表,在“2019年25號”中三表合一為《參比制劑遴選申請表》,填寫內容也有變動,主要區別為:擬評價品種信息中無需填寫質量標準、主成分分子式、擬評價方法;擬定參比制劑相關信息中無需填寫主成分分子式和聲明,新增加申請類型(申請/推薦/自證作為參比制劑)。
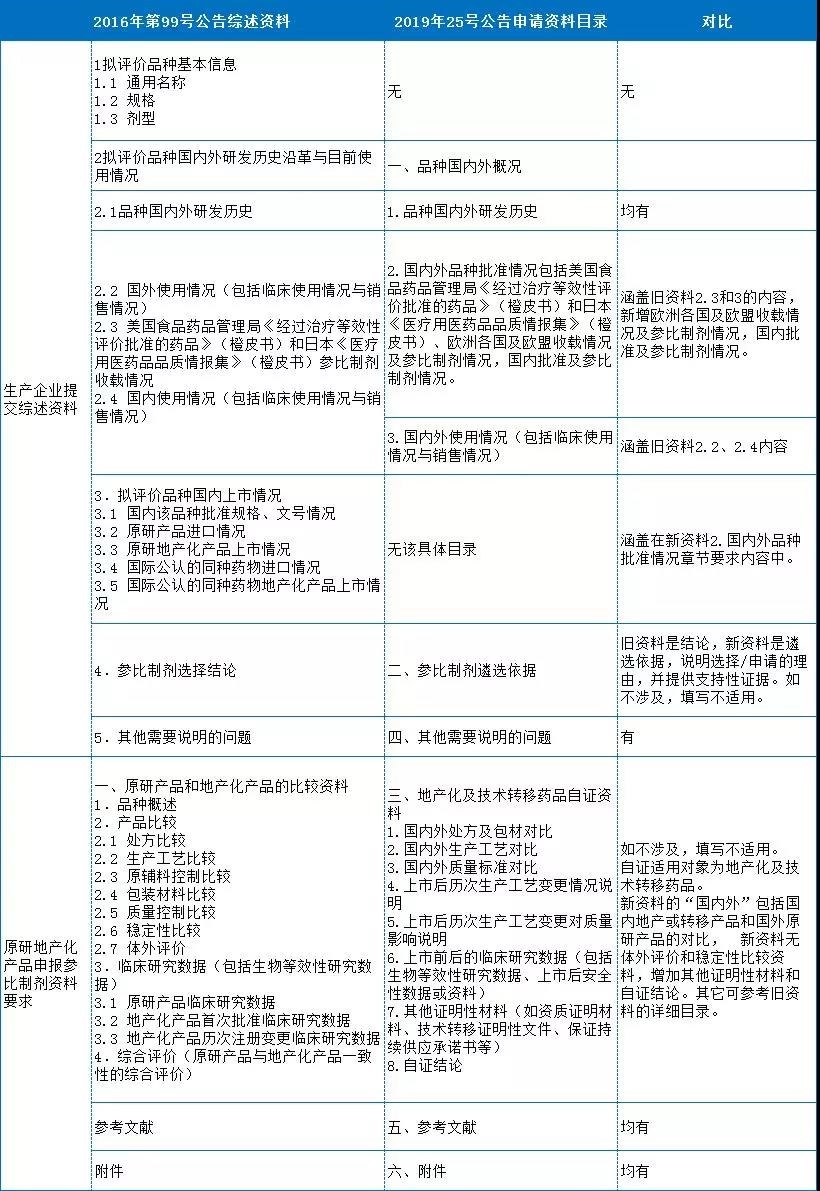
4、參比制劑遴選申請資料目錄
“2019年第25號”公告中的申請資料目錄更為精簡,適用對象包括生產企業、行業協會和自證企業,主要區別在于國內外品種批準情況和自證資料。在新公告中,國內外品種批準情況包括國內批準情況(可同舊資料3)和國內參比制劑情況(新增,包括國家已公布和其它企業申報公示和藥監局發布情況等),以及美國、日本橙皮書和歐洲各國收載及參比制劑情況(主要針對原研和國際公認同種藥物)。最新公告申請資料中的自證資料還含新增技術轉移藥品。
參比制劑申報資料的對比詳見表2:
表2 參比制劑申報資料的對比